sábado, 18 de agosto de 2012
terça-feira, 14 de agosto de 2012
as bases
Em 1923, o químico dinamarquês Johannes Nicolaus Brønsted e o inglês Thomas Martin Lowry propuseram a seguinte definição: Uma base é um aceitador de prótons (íon hidrônio H+)
Mais tarde Gilbert Lewis definiu como base qualquer substância que doa pares de elétrons não ligantes, numa reação química - doador do par electrônico.
- H2SO4 + Ca(OH)2 → 2 H2O + CaSO4(ácido sulfúrico + hidróxido de cálcio = água + sulfato de cálcio)HCl + NaOH → H2O + NaCl(ácido clorídrico + hidróxido de sódio = água + cloreto de sódio)Classificação das basesQuanto ao número de hidroxilas
- Bases fortes: São as que dissociam muito. Em geral os metais alcalinos e alcalino-terrosos formam bases fortes (família IA e IIA da Tabela periódica). Porém, o hidróxido de Berílio e o hidróxido de Magnésio são bases fracas.
- Bases fracas: São as bases formadas pelos demais metais e o hidróxido de amônio, por terem caráter molecular.
- Solúveis: Todas as bases formadas pelos metais alcalinos são solúveis. Podemos citar também o hidróxido de amônio, que apesar de ser uma base fraca, é solúvel.
- Pouco solúveis: São as bases formadas pelos metais alcalino-terrosos em geral.
- Insolúveis: As demais bases. Vale lembrar sempre alguma parcela dissolve, mas chama-se insolúvel quando essa quantidade é insignificante em relação ao volume total.
- Sabor adstringente.
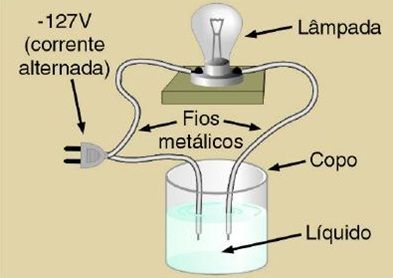
- Sofrem dissociação quando em solução aquosa; há separação dos íons conduzindo corrente elétrica.
- Base é toda a substância que, em solução aquosa libera como ânion exclusivamente OH- (hidróxido).
- Quando são dissolvidos em água, os hidróxidos tem seus íons separados. O cátion é um metal, e o ânion é OH-.
Quanto ao grau de dissociação
terça-feira, 31 de julho de 2012
oÁCIDOS:
Existem várias definições para ácidos, das quais a mais utilizada é a definição do químico Svant August Arrhenius. Segundo ele, ácidos são compostos que em solução aquosa, ionizam-se e liberam exclusivamente como cátion o íon H3O+ (hidrônio ou hidroxônio).n Cloro e como cátion o íon Hidroxônio.
HCl + H2O --------> Cl - + H3O +.Observe o esquema a seguir:
simplificando:
HCl + H2O --------> Cl - + H +.
Note que o ácido clorídrico quando reage com a água, libera como ânion o íon Cloro e como cátion o íon Hidroxônio.
Classificação dos ácidos quanto ao número de hidrogênios ionizáveis:
- Monoácidos » Apresentam apenas um hidrogênio ionizável. Exemplos: HBr, HCl, HNO3, HF.
- Diácidos » Apresentam dois hidrogênios ionizáveis. Exemplos: H2SO4, H2CO3, H2S.
- Triácidos » Apresentam três hidrogênios ionizáveis. Exemplos: H3BO3, H3PO4.
- Tetrácidos » Apresentam quatro hidrogênios ionizáveis. Exemplos: H4SiO4, H4P2O7.
Classificação dos ácidos quanto ao número de elementos constituintes:
- Binários » Apresentam dois elementos. Exemplos: HBr, HCl, H2S, HF.
- Ternários » Apresentam três elementos. Exemplos: H2SO4, H3PO4.
- Quaternários » Apresentam quatro elementos. Exemplos: HOCN.
Classificação dos ácidos quanto à presença de oxigênio na molécula:
- Oxiácidos » Apresentam oxigênio na molécula. Exemplos: H4SiO4, H2SO4, H3PO4.
- Hidrácidos » Não apresentam oxigênio na molécula. Exemplos: HBr, HCl, HF.
Nomenclatura dos ácidos:
Um dos maiores problemas para os alunos do ensino médio na química, é a nomenclatura das substâncias. Percebemos que toda a dificuldade estava no fato de que os alunos não conhecem os nomes dos ânions; sabendo que sem o devido aprendizado dos nomes dos ânions, fica praticamente impossível seu aprendizado para escrever as fórmulas e os nomes da substâncias. Expomos a necessidade de que você aprenda no mínimo os principais ânions.
Para a nomenclatura dos ácidos, proceda da seguinte forma:
Exemplo: HCl.
ÁCIDO + NOME DO ÂNION COM A TERMINAÇÃO ALTERADA.
|
A alteração deverá ser feita da seguinte forma:
terminação do ânion
|
alteração
|
| ito | oso |
| ato | ico |
| eto | ídrico |
O ânion Cl-, chama-se cloreto, logo a terminação do ácido será ídrico.
O HCl, chama-se Ácido Clorídrico.
domingo, 29 de julho de 2012
eletrólitos e não eletrólitos
Eletrólitos e não-eletrólitos
Eletrólitos são substâncias que, quando dissolvidas em água, conduzem a corrente elétrica.São exemplos de eletrólitos, o NaCl e o HCl. Não eletrólitos, nesta mesma condição, não conduzem a corrente elétrica. São exemplos de não-eletrólitos, o açúcar e o álcool etílico (C2H5OH). Todos os compostos iônicos são eletrólitos e alguns moleculares (ou covalentes) também.
Teoria de Arrhenius: se a solução aquosa de certa substância não conduz corrente elétrica, essa solução é chamada de solução não-eletrolítica e a substância, de não-eletrólito. Os não-eletrólitos sempre são moleculares. Quando a solução conduz corrente elétrica, ela é chamada de solução eletrolítica, e a substância, de eletrólito.
Teoria de Arrhenius: se a solução aquosa de certa substância não conduz corrente elétrica, essa solução é chamada de solução não-eletrolítica e a substância, de não-eletrólito. Os não-eletrólitos sempre são moleculares. Quando a solução conduz corrente elétrica, ela é chamada de solução eletrolítica, e a substância, de eletrólito.
segunda-feira, 25 de junho de 2012
ligações
ligação covalente
As ligas metálicas são preferenciais na fabricação de alguns objetos, por possuírem características que os metais puros não possuem, como por exemplo: a liga de ouro usada nas joalherias. A característica dessa liga é de aumentar a dureza do material, a liga de ouro é composta pela ligação entre ouro, prata e cobre.
Nessa ligação, os átomos são unidos devido ao compartilhar de seus elétrons, surgem então os pares eletrônicos indicados pelo círculo:

Cada par eletrônico formado pertence simultaneamente aos dois átomos. As moléculas são estruturas eletricamente neutras porque não ocorre nem ganho nem perda de elétrons, apenas o compartilhamento.
A água é um composto molecular constituído por dois átomos de hidrogênio (H2) e um de oxigênio (O).
ligação iônica
Quando ocorrem ligações entre íons positivos (cátions) e negativos (ânions) denominamos de Ligações Iônicas. Essa ligação é a única em que a transferência de elétrons é definitiva. Uma ligação iônica envolve forças eletrostáticas que atraem íons de cargas opostas. Íons são átomos em desequilíbrio elétrico e apresentam carga positiva ou negativa.
ligação metálica
ligação metálica
As ligas metálicas são preferenciais na fabricação de alguns objetos, por possuírem características que os metais puros não possuem, como por exemplo: a liga de ouro usada nas joalherias. A característica dessa liga é de aumentar a dureza do material, a liga de ouro é composta pela ligação entre ouro, prata e cobre.
Óxi - Uma droga mais devastadora e letal que o crack
A droga óxi ou oxidado é obtida a partir da mistura da pasta base da cocaína com cal virgem e algum combustível como querosene, gasolina e água de bateria. Por estes componentes serem mais baratos que os do crack, seu uso está se alastrando. Mas ela é mais letal.
quinta-feira, 14 de junho de 2012
Ligação covalente polar - Os átomos ligados têm diferente eletronegatividade. A toda ligação covalente polar está associado um vetor polarização, orientado da carga negativa para a positiva (vetor localizado no centro das distâncias entre as cargas). São polares quando sua eletronegatividade é menor que 1,7 e diferente de zero.
Ligação covalente polar - Ligação intermediária entre a ligação covalente apolar e a ligação iônica.
Polaridade das moléculas:
Molécula apolar - A soma vetorial dos vetores polarização associados a todas as ligações covalentes polares da molécula é nula.
Molécula polar - A soma vetorial dos vetores polarização associados a todas as ligações covalentes polares na molécula é diferente de zero.
domingo, 3 de junho de 2012

Proteja os olhos do gás volátil da cebola.
Qual a relação entre a química e as lágrimas que surgem quando cortamos cebolas? A química está envolvida desde o cheiro até a reação que provoca em nossos globos oculares, a cebola possui várias substâncias químicas que estimulam nosso olfato, paladar e infelizmente nossos olhos.
Vamos começar pelo cheiro, qual composto é responsável por aquele delicioso cheirinho de cebola frita na manteiga? São os óxidos sulfúricos derivados do ácido sulfúrico (H2SO4).
Agora para explicar sobre as lágrimas precisamos ir um pouco além. Quando realizamos o corte de uma cebola, esta libera enzimas denominadas de alinases, estas por sua vez reagem com o óxido sulfúrico já presente na estrutura da cebola. A reação dá origem ao ácido sulfínico que, por ser pouco estável, acaba se transformando em um gás volátil.
O gás obtido na reação ao se volatilizar chega até os olhos provocando uma reação desagradável nos terminais nervosos da córnea, e para se defender estes terminais ativam as glândulas lacrimais, estas por sua vez liberam as lágrimas: a hora do choro!
Existem diversas maneiras de prevenir este aborrecimento, um deles é cortar as cebolas utilizando o ventilador. Ligue um ventilador ao seu lado e em direção transversal apontado para a cebola de modo que o gás não chegue aos seus olhos.
Vamos começar pelo cheiro, qual composto é responsável por aquele delicioso cheirinho de cebola frita na manteiga? São os óxidos sulfúricos derivados do ácido sulfúrico (H2SO4).
Agora para explicar sobre as lágrimas precisamos ir um pouco além. Quando realizamos o corte de uma cebola, esta libera enzimas denominadas de alinases, estas por sua vez reagem com o óxido sulfúrico já presente na estrutura da cebola. A reação dá origem ao ácido sulfínico que, por ser pouco estável, acaba se transformando em um gás volátil.
O gás obtido na reação ao se volatilizar chega até os olhos provocando uma reação desagradável nos terminais nervosos da córnea, e para se defender estes terminais ativam as glândulas lacrimais, estas por sua vez liberam as lágrimas: a hora do choro!
Existem diversas maneiras de prevenir este aborrecimento, um deles é cortar as cebolas utilizando o ventilador. Ligue um ventilador ao seu lado e em direção transversal apontado para a cebola de modo que o gás não chegue aos seus olhos.

Macarrão de alto valor nutricional.
A modernidade trouxe mudanças em nossos hábitos, no vestuário e até em nossa alimentação. Diante da correria do dia a dia, quem nunca teve de se conformar com um macarrão instantâneo na hora do almoço? O miojo (nome popular para este tipo de macarrão) veio como uma alternativa para os “apressadinhos” que se quer tem tempo para se alimentar direito.
Agora uma dúvida: será que esse alimento nutre nosso corpo garantindo a reposição física? É claro que não se deve substituir nosso nutritivo e tradicional arroz com feijão por esta guloseima. Apresentamos aqui alguns dos ingredientes presentes nesse tipo de macarrão que permitem que este alimento seja consumido esporadicamente para nosso sustento físico.
Extrato de levedura: este aditivo, também encontrado na cerveja, é rico em vitaminas do complexo B e adicionado ao macarrão para torná-lo mais nutritivo.
Vitamina B6: também conhecida como piridoxina, é encontrada em frutas e cereais e acrescentada ao alimento para completar o complexo vitamínico.
Em se tratando do sabor característico, temos dois ingredientes:
Guanilato dissódico: um pó branco fino que é usado para intensificar o sabor, esse ingrediente também pode ser encontrado em batatas fritas e sopas instantâneas.
Glutamato monossódico: aminoácido que ativa as papilas gustativas e realça o gosto do alimento.
Agora uma dúvida: será que esse alimento nutre nosso corpo garantindo a reposição física? É claro que não se deve substituir nosso nutritivo e tradicional arroz com feijão por esta guloseima. Apresentamos aqui alguns dos ingredientes presentes nesse tipo de macarrão que permitem que este alimento seja consumido esporadicamente para nosso sustento físico.
Extrato de levedura: este aditivo, também encontrado na cerveja, é rico em vitaminas do complexo B e adicionado ao macarrão para torná-lo mais nutritivo.
Vitamina B6: também conhecida como piridoxina, é encontrada em frutas e cereais e acrescentada ao alimento para completar o complexo vitamínico.
Em se tratando do sabor característico, temos dois ingredientes:
Guanilato dissódico: um pó branco fino que é usado para intensificar o sabor, esse ingrediente também pode ser encontrado em batatas fritas e sopas instantâneas.
Glutamato monossódico: aminoácido que ativa as papilas gustativas e realça o gosto do alimento.
A DISTRIBUIÇÃO ELETRÔNICA
A DISTRIBUIÇÃO ELETRÔNICA!
Um problema para os químicos era construir uma teoria consistente que explicasse como os elétrons se distribuíam ao redor dos átomos, dando-lhes as características de reação observadas em nível macroscópico.
Foi o cientista americano Linus C. Pauling quem apresentou a teoria até o momento mais aceita para a distribuição eletrônica.
1. Distribuição Eletrônica em átomos neutros
Para fazermos a distribuição eletrônica de um átomo neutro, devemos conhecer o seu número atômico (Z) e, conseqüentemente, seu número de elétrons e distribuí-los em ordem crescente de energia dos subníveis, segundo odiagrama de Pauling.
2. Distribuição Eletrônica em Íons
veja agora imagens da distribuição eletrônica:
terça-feira, 29 de maio de 2012
pequenas frases de um grande cientista!
"A imaginação é mais importante que o conhecimento."
"A mente que se abre a uma nova idéia jamais voltará ao seu tamanho original."
"O mundo é um lugar perigoso de se viver, não por causa daqueles que fazem o mal, mas sim por causa daqueles que observam e deixam o mal acontecer."
"A mente que se abre a uma nova idéia jamais voltará ao seu tamanho original."
"O mundo é um lugar perigoso de se viver, não por causa daqueles que fazem o mal, mas sim por causa daqueles que observam e deixam o mal acontecer."
quinta-feira, 24 de maio de 2012
a química

Diferentemente do que muitos estudantes pensam, a Química é uma ciência que não está limitada somente às pesquisas de laboratório e à produção industrial. Pelo contrário, ela está muito presente em nosso cotidiano das mais variadas formas e é parte importante dele.
Seu principal foco de estudo é a matéria, suas transformações e a energia envolvida nesses processos. A Química explica diversos fenômenos da natureza e esse conhecimento pode ser utilizado em benefício do próprio ser humano.
Os avanços da tecnologia e da sociedade só foram possíveis graças às contribuições da Química. Por exemplo: na medicina, em que os medicamentos e métodos de tratamento têm prolongado a vida de muitas pessoas; no desenvolvimento da agricultura; na produção de combustíveis mais potentes e renováveis; entre outros aspectos extremamente importantes.
terça-feira, 22 de maio de 2012

A estrutura atômica e muito mais é estudada nesta frente da química.
Química é a ciência que estuda a estrutura das substâncias, a composição e as propriedades das diferentes matérias, suas transformações e variações de energia.
Ela conquistou um lugar central e essencial em todos os assuntos do conhecimento humano. Relaciona-se com outras ciências como a Biologia, Ciências Ambientais, Física, Medicina e Ciências da Saúde.
A Química é útil em inúmeras atividades, como, por exemplo, na agricultura, onde os agricultores a utilizam para melhorar a acidez do sol. Os médicos também precisam do conhecimento químico para reconhecer a composição das substâncias utilizadas como medicamento.
A Química é uma ciência experimental que teve seu processo de descoberta ligado à preocupação que as culturas antigas tinham em compreender a relação entre o ser humano, a natureza e seus fenômenos: a chamada Alquimia.
Ela conquistou um lugar central e essencial em todos os assuntos do conhecimento humano. Relaciona-se com outras ciências como a Biologia, Ciências Ambientais, Física, Medicina e Ciências da Saúde.
A Química é útil em inúmeras atividades, como, por exemplo, na agricultura, onde os agricultores a utilizam para melhorar a acidez do sol. Os médicos também precisam do conhecimento químico para reconhecer a composição das substâncias utilizadas como medicamento.
A Química é uma ciência experimental que teve seu processo de descoberta ligado à preocupação que as culturas antigas tinham em compreender a relação entre o ser humano, a natureza e seus fenômenos: a chamada Alquimia.
Assinar:
Comentários (Atom)